![Фосфорная кислота [H3PO4]: Структура | Свойства | Применение](https://noelle.ru/wp-content/uploads/2022/07/15968280092659854-3.jpg)
Фосфорная кислота представляет собой агрессивную неорганическую кислоту с химической формулой H3PO4. Это слабая кислота, доступная в различных количествах, степени чистоты и степени реактивности.
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде представляет собой вязкую жидкость без запаха плотностью 1,885 г/мл. Обычно он нелетучий и нетоксичный, но 85% раствор может вызвать повреждение глаз и сильное раздражение кожи.
Номенклатура IUPAC для этого соединения — ортофосфорная кислота. Орто — это греческий термин, означающий «истинный», поэтому приставка «орто» относится к истинной форме фосфорной кислоты, H3PO4.
Давайте углубимся и узнаем, как производится фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Температура кипения: 212°С
Температура плавления: 42,35 ° C (кристаллическое твердое вещество)
Динамическая вязкость: от 2,4 до 9,4 сП (85% водный раствор)
Плотность: 1,83 г/см3 (твердый); 1,68 г/см3 (85% водный раствор при 25°С)
![Фосфорная кислота [H3PO4]: Структура | Свойства | Применение](https://noelle.ru/wp-content/uploads/2022/07/15968280103659854.jpg)
Соединение H3PO4 имеет всего 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, его помещают в центр. Атомы водорода прикрепляются к внешней стороне атомов кислорода, образуя on-группу.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют по восемь валентных электронов, а атомы водорода имеют два валентных электрона.
Фосфор может иметь расширенный октет (более восьми валентных электронов), поэтому он получает формальный заряд +1, а кислород (не связанный с атомом водорода) получает формальный заряд -1. Образуя двойную связь, фосфор и кислород теряют свои заряды.
В структуре по-прежнему 32 валентных электрона, и каждый атом имеет формальный нулевой заряд. Так что это наиболее вероятная или возможная структура Льюиса для H3PO4.
Соединение имеет 3 одинарных связи ОН, 3 одинарных связи PO и 1 двойную связь P = O. Каждая одинарная связь представляет собой сигма-связь, а двойная связь состоит из сигма-связи и пи-связи.
![Фосфорная кислота [H3PO4]: Структура | Свойства | Применение](https://noelle.ru/wp-content/uploads/2022/07/15968280114659854-1.jpg)
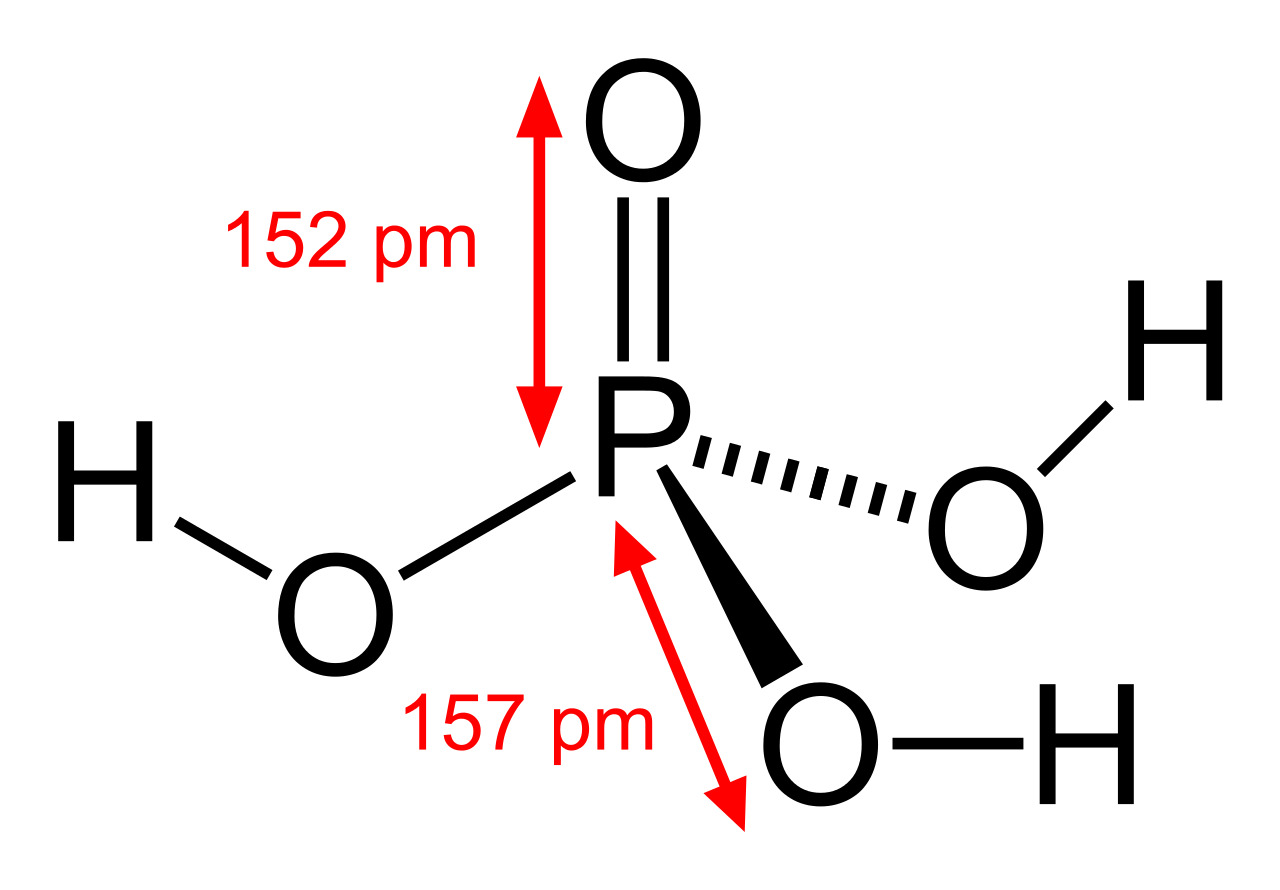
Фосфорная кислота: сферическая модель и размеры структурной формулы
Молекулярная геометрия PO(OH) 3 тетраэдрическая, а кристаллическая структура моноклинная. А так как распределение зарядов у центральных атомов несимметрично, то молекула считается полярной.
Недавние достижения в области нанотехнологий, в том числе методы поглощения рентгеновских лучей на ближней границе и рассеяния рентгеновских лучей под большими углами, позволили ученым определить структуру фосфорной кислоты. Расстояние связи P = O в структуре близко к 152 пикометрам, а расстояние P = O-O уточнено до 309 пикометров, при этом валентный угол близок к тетраэдру.
Как это делается?
Фосфорная кислота может быть синтезирована влажным или термическим способом.
Последний использует в качестве сырья воздух, воду и элементарный фосфор. Он включает в себя три важных этапа: сжигание, увлажнение и распыление. Вот как это работает:
Сначала жидкий элементарный фосфор сжигают в камере сгорания при высокой температуре от 1650 до 2760°С. Эта реакция окисления происходит в окружающем воздухе и приводит к образованию пятиокиси фосфора.
4П + 5О 2 ->
2 П 2 О 5
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в виде жидкости).
Р 2 О 5 + 6 Н 2 О ->
2 П 2 О 5
На последнем этапе для удаления тумана фосфорной кислоты из потока дымовых газов используются каплеуловители высокого давления.
Концентрация фосфорной кислоты, синтезируемой этим способом, обычно составляет от 75 до 85%. Эти уровни концентрации необходимы для производства высококачественных химикатов. Несколько эффективных заводов извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя один и тот же термический процесс.
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатным минералом, таким как гидроксиапатит.
Ca 5 (PO 4) 3 OH + 5 H 2 SO 4 ->
3 H 3 PO 4 + 5 CaSO 4 + H 2 O
Минерал сушат, измельчают и затем вместе с серной кислотой подают в реактор. В результате реакции сульфат соединяется с кальцием (из минерала) с образованием сульфата кальция (гипса).
![Фосфорная кислота [H3PO4]: Структура | Свойства | Применение](https://noelle.ru/wp-content/uploads/2022/07/159682801258484.jpg)
Затем добавляют очищенную воду и гипс вместе с другими нерастворимыми примесями удаляют через фильтр. Фосфорная кислота, полученная в этом мокром процессе, содержит 25-30% пятиокиси фосфора.
Как правило, эту кислоту дополнительно загущают, чтобы удовлетворить требования производства удобрений. В большинстве случаев фосфорную кислоту концентрируют до 40-55% пятиокиси фосфора с помощью двух или трех вакуум-выпарных аппаратов.
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое вещество, плавящееся при 42,35°С. Его физические свойства зависят от его чистоты, концентрации кислоты и температуры, при которой мы его видим.
Фосфорная кислота менее агрессивна и менее опасна, чем азотная и серная кислоты. Это негорючее вещество как в жидком, так и в твердом виде.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное хрупкое стекло. После такого термического воздействия кислотный состав остается неизменным.
Фосфорная кислота обычно выпускается в виде бесцветного сиропа с концентрацией в воде 85% и плотностью 1885 г на миллилитр.
![Фосфорная кислота [H3PO4]: Структура | Свойства | Применение](https://noelle.ru/wp-content/uploads/2022/07/15968280136659854-2.jpg)
В водном растворе фосфорная кислота существует в виде трехвалентной кислоты, которая имеет три ионизируемых атома водорода. Соединение может терять эти атомы в виде протонов (ионов Н+).
После удаления одного протона образуется дигидрофосфат-ион H 2 PO 4 -.
После удаления двух протонов образуется ион гидрофосфата HPO 4 2-
Удаление всех трех протонов дает ион ортофосфата PO 4 3-.
Эта кислота растворима как в воде, так и в этаноле. Однако большинство его солей нерастворимы в воде, если только это не сильная минеральная кислота.
Фосфорная кислота имеет несколько важных применений. Его соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется в производстве электролитов, средств для удаления ржавчины, модификаторов pH, травителей, чистящих и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренную кислотность, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для зубов и ухода. Давайте подробнее рассмотрим, чем полезна ортофосфорная кислота.
В менее концентрированной форме он используется для производства различных видов безопасных фосфорных удобрений, поддерживающих рост растений. Фактически почти 90% синтезируемой фосфорной кислоты используется в качестве удобрения.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый привкус. Хотя его концентрация довольно низкая, чрезмерное употребление таких напитков может разрушить зубы и даже привести к образованию камней в почках.
Фосфорная кислота в качестве электролита обладает такими полезными свойствами, как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и отличной термостабильностью, полибензимидазол (ПБИ), легированный фосфорной кислотой, является наиболее перспективным из мембран на основе ПБИ, которые могут обеспечить хорошие характеристики топливного элемента даже при низком смачивании и температуре 200°С.
Конкретное использование фосфорной кислоты:
Трифосфат натрия используется в мыле и моющих средствах.
Дикальцийфосфат используется в зубной пасте в качестве полирующего агента.
Фосфат наносится на стальные детали для защиты от коррозии и смазки.
Он используется для контроля рН косметики и средств личной гигиены.
В строительстве используется для удаления минеральных отложений и очистки от пятен от жесткой воды,
Многие развивающиеся страны начали уделять особое внимание увеличению добычи и производства фосфатной руды.Некоторые правительства уже установили партнерские отношения с различными поставщиками по всему миру для создания заводов по добыче полезных ископаемых для производства фосфорной кислоты.
В 2019 году мировой рынок фосфорной кислоты оценивался в 45,85 млрд долларов.Ожидается, что к 2027 году он превысит 61 миллиард долларов, а совокупный годовой темп роста составит 3,7%.
Рынок разделен на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку.Ожидается, что в ближайшем будущем на мировом рынке будут доминировать страны Азии и Тихого океана.Дальнейшему росту рынка фосфорной кислоты в этих регионах будет способствовать развитый сельскохозяйственный сектор Индии и Китая.